
【引言】
纳米磁响应性多孔材料由于其独特的磁学特性(可被磁化、交变磁场下产热等)和多孔结构,可被用于分离富集、磁靶向药物定点释放、固定酶/纳米催化剂等,在生物医学、催化等领域有着重要的应用价值。 除了具有传统的零维磁性纳米材料的特征以外,一维磁性纳米材料(纳米链、纳米线、纳米棒等)还具有可控的长径比、各向异性以及在动态磁场中产生局域物理剪切力等效应,近年来成为纳米材料领域的一个重要研究对象。目前,一维磁性纳米材料的合成方法主要包括水热/溶剂热法、磁偶极组装法、静电纺丝法等,但是这些方法得到的一维纳米材料往往不具备可控的稳定结构和表面结构功能,且比表面积较低,识别、负载客体分子能力低,制约了其在应用潜力。
【成果简介】
近日,复旦大学化学系邓勇辉教授课题组报道了一种基于磁场诱导界面共组装的方法,首次合成了一种由磁性纳米内核和介孔二氧化硅外壳组成的核壳结构一维纳米链材料(Fe3O4@nSiO2@mSiO2 nanochain,Magn-MSNCs)。其合成过程包括两个步骤:第一步,具有稳定刚性结构Fe3O4@nSiO2纳米链的可控合成:通过静磁场的诱导取向,实现零维磁性Fe3O4纳米颗粒的定向组装和二氧化硅在其界面的生长包覆,得到长度可控的一维纳米链;第二步,介孔二氧化硅外层的可控生长:在正己烷存在下,通过表面活性剂十六烷基三甲基溴化铵(CTAB)与二氧化硅前驱体正硅酸四乙酯(TEOS)在溶剂中的界面共组装,在Fe3O4@nSiO2纳米链上进一步包覆上一层孔径可调的介孔二氧化硅,得到具有双壳层结构的Fe3O4@nSiO2@mSiO2磁性介孔二氧化硅纳米链(合成步骤如图1所示,形貌表征如图2所示)。该材料具有较高的比表面积(317 m2/g)、较大的垂直取向介孔(7.3 nm)和良好的磁响应性能(饱和磁化强为度34.9 emu/g,图3所示)。由于其特殊的一维链状结构,这些纳米链在外加磁场静态磁场中呈现出取向性排列(图4),而在动态磁场中,该纳米链能随着磁场方向的变化产生响应,显示出快速转动现象。研究团队充分利用该材料外层中较大孔径的介孔孔道,实现了金纳米颗粒的高效负载,并用于硝基苯酚的催化加氢反应,磁性纳米链在反应液中随外加磁场旋转,加速了催化反应的进行,显示了良好的催化效果(图5)。该材料同时起到催化剂载体和磁性搅拌子的双重作用,利用其磁分离特性,负载的贵金属催化剂可以方便磁分离回收。此外,课题组与第二军医大学长海医院合作,发现这种磁性介孔二氧化硅纳米链材料作为药物(唑来膦酸盐,一种抑制破骨细胞分化的常用药物)载体能够被骨髓源性巨噬细胞(BMMs)吞噬进入细胞体内(图6)。在外加动态磁场下,磁性纳米链在细胞内限域微环境下产生较强的物理剪切力,改变细胞内的功能状态,同时其负载的药物被有效释放在细胞内,从而实现了抑制破骨细胞的分化作用。这种独特的一维磁性纳米多孔材料有望在微型催化、微型纳米反应器、微纳药物释放等诸多领域得到重要应用。相关研究成果以“A MagneTIc-Field Guided Interfacial Co-Assembly Approach to MagneTIc Mesoporous Silica Nanochains for Osteoclast-Targeted InhibiTIon and Heterogeneous Nanocatalysis”为题,发表在Advanced Materials (Adv. Mater. 2018, 1707515 DOI: 10.1002/adma.201707515)上,第一作者为复旦大学化学系硕士研究生万里,通讯作者为复旦大学邓勇辉教授和第二军医大学长海医院苏佳灿教授。
【图文导读】
图1. 材料合成步骤示意图
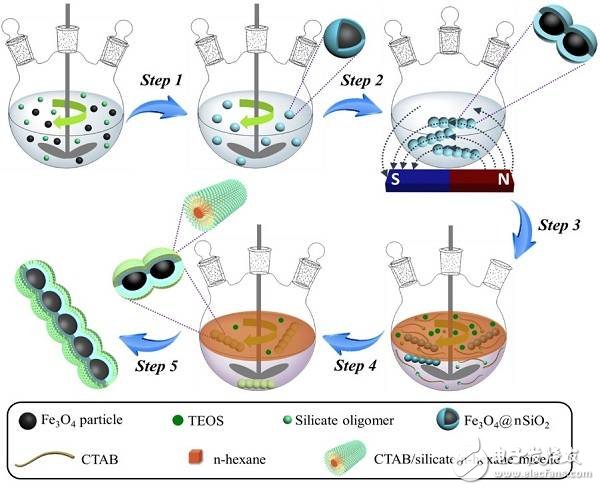
第一步:将Fe3O4颗粒分散于乙醇中,并在表面初步包覆一层无定形SiO2;
第二步:与此同时,在反应体系中施加静磁场,诱导纳米颗粒组装排列成一维结构,同时进一步被致密的无孔SiO2包裹固定,最终形成Fe3O4@nSiO2纳米链;
第三步:将得到的纳米链重新分散于水和正己烷的两相溶剂中,加入CTAB作为模板剂;
第四步:在Fe3O4@nSiO2表面以CTAB为软模板,再包覆一层介孔二氧化硅;
第五步:冷凝回流脱除CTAB模板剂,得到最终的Fe3O4@nSiO2@mSiO2纳米链(Magn-MSNCs)
图2. 材料形貌的电镜表征
(a)Fe3O4纳米颗粒的TEM图片,
(b, c)Fe3O4@nSiO2纳米链的SEM/TEM图片,
(d, e, f)Fe3O4@nSiO2@mSiO2纳米链的SEM/TEM图片,可以观察到该材料具有稳定的一维核壳结构和有序的垂直发散介孔孔道。
图3. 材料结构和磁性等表征
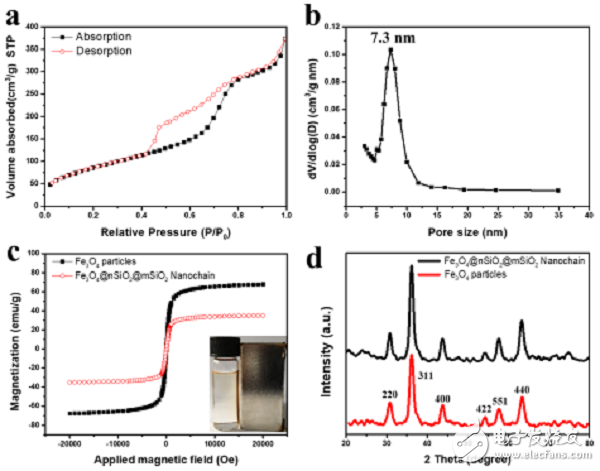
(a)N2吸附/脱附曲线,得到介孔纳米链比表面积为317 m2/g;
(b)孔径分布曲线;
(c)Fe3O4和磁性介孔二氧化硅纳米链Magn-MSNCs的磁滞回线,得到纳米链的饱和磁化强度为34.9 emu/g;
(d)Fe3O4和磁性介孔二氧化硅纳米链Magn-MSNCs的XRD数据,Fe3O4的晶相稳定保持。
图4. 不同浓度的磁性纳米链材料在磁场下的SEM(d, e, f)与不施加磁场时的SEM图片(a, b, c)对比

磁性纳米链浓度分别为:
(a, b)0.4 mg/mL;
(c, d)0.8 mg/mL;
(e, f)1.2 mg/mL ;
无外加磁场时,纳米链材料呈现无序排列的状态;施加磁场之后,纳米链都会明显呈现和磁场方向一致的排布。
图5. 纳米链负载金纳米颗粒用于硝基苯酚的催化加氢还原
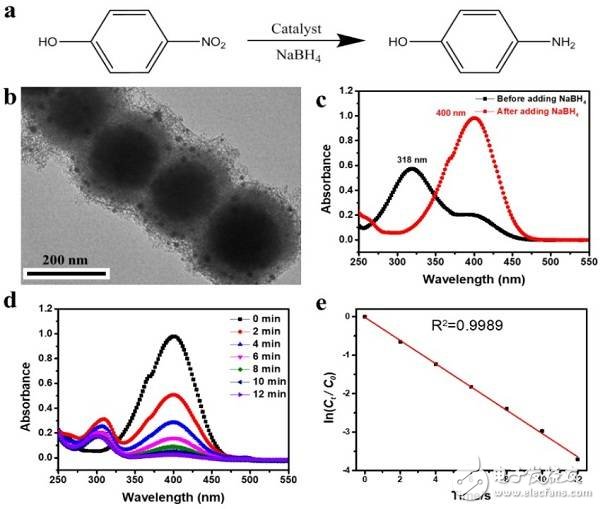
(a)对硝基苯酚催化加氢反应;
(b)负载了金纳米颗粒的纳米链(Magn-MSNCs/Au)的TEM图片,显示均匀分散的金纳米颗粒;
(c)反应体系在加入NaBH4前后的紫外光谱吸收峰的位移;
(d)加入还原剂NaBH4之后不同时间的紫外吸收光谱;
(e)催化反应的以及动力学速率曲线(一级动力学反应常数k = 0.30 min-1)。
图6. 纳米链负载药物实现抑制BMMs靶向破骨分化
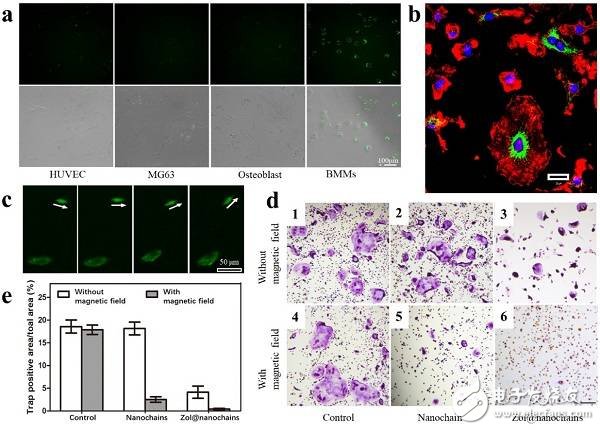
(a)HUVEC、MG63、成骨细胞(Osteoblast)及骨髓源性巨噬细胞(BMMs)与绿色荧光标记的Magn-MSNCs孵育后的荧光显微镜照片,可以观察到该材料对于BMMs的靶向性;
(b)荧光标记的Magn-MSNCs在BMMs内的激光共聚焦显微镜静态图片;
(c)动态磁场下荧光标记的Magn-MSNCs在BMMs内不同时间变化的荧光显微镜图片;
(d)破骨细胞(紫色)分化的光学显微镜图片,1-3无外加磁场,4-6为动态磁场处理,1/4为参照组,2/5为加入纳米链Magn-MSNCs处理组,3/6为加入负载药物唑来膦酸(zoledronate)的Magn-MSNCs处理组,可以看到6为最佳处理效果,即药物和动态磁场的协同作用;
(e)TRAP染色阳性面积的定量分析。
【小结】
该研究介绍了一种磁场诱导界面共组装合成方法,合成了具有核-壳结构、垂直发散介孔孔道的磁性二氧化硅纳米链材料Fe3O4@nSiO2@mSiO2(Magn-MSNCs),该材料特有的介孔壳层十分有利于负载药物、贵金属和生物酶等,而其磁响应性能和一维纳米材料独特的各向异性使其在动态磁场在反应体系中发生转动,产生剪切作用,加速体系反应的进行,从而同时起到了载体和磁性搅拌子的双重作用。另一方面,磁性材料催化剂通过外加磁场可实现高效分离与回收。因此,该材料有望在催化、生物医药等领域得到广泛应用。该工作得到了复旦大学化学系、聚合物分子工程国家重点实验室、2011能源材料化学协同创新中心(iChEM)以及国家万人计划青年拔尖人才支持和国家自然科学基金优秀青年基金的大力支持。
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)