[拼音]:p-V-T guanxi
[外文]:p-V-T relation
物质在平衡状态下压力(p)-体积(V)-温度(T)之间的相互关系的简称。这三个变量之间存在一定的关系,如物质体积的热胀冷缩和随压力增加而减小,这都是人们所共知的现象。在化工热力学中,需要对各种物质特别是对流体(气体和液体的统称)的p-V-T关系进行定量研究。其目的之一是直接利用p-V-T数据,对已知温度、压力的流体作质量与体积的互算,进而用于计算流体的流量、输送管道、反应器等的几何尺寸。其目的之二是利用p-V-T关系计算某些不能直接测定的热力学性质如焓、熵、逸度等,进而作热力学过程的热功计算或相平衡计算、化学平衡计算。一定量纯物质的p-V-T关系常在三维直角坐标系中表示,称作p-V-T关系立体图。
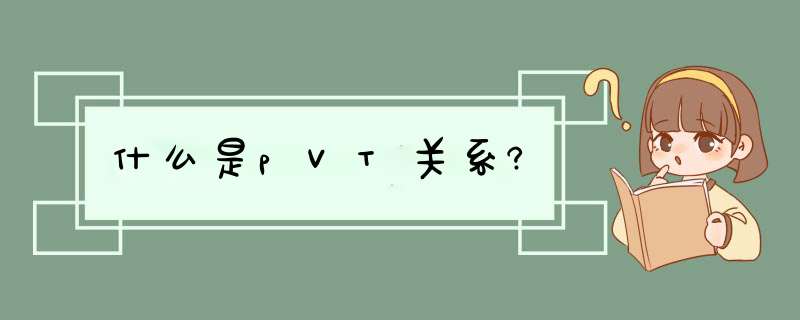
典型p-V-T关系立体图一定量纯物质在平衡状态下的p-V-T关系,在以p、Vm(摩尔体积)和T为坐标轴的空间形成曲面(图1),
它表明在p、Vm、T三个变量中确定了任何两个变量之后,第三个变量即可随之确定,并可从图中曲面读出其数值。曲面的不同部位可以表示不同的相,包括单相或两相共存,甚至三相共存。当物质的p、Vm、T数值落在单相区时,系统中只能存在一个相(气相、液相或固相);当p、Vm、T数值落中两相区时,系统就为两相(汽液、汽固或液固)共存;当物质的p、Vm、T数值恰好落在三相共存线上时,系统就为汽液固三相共存。
图中的LCV是汽液共存面。通过此面的O点,作等温面或等压面与LCV面相交于L′OV′线,L′和V′分别代表平衡时的液相和汽相。两相的温度、压力与 O点相同,但摩尔体积不等。液相摩尔体积小,汽相摩尔体积大。汽相与液相的相对量则取决于O点的具体位置,O点越接近L′点,液相量越多。随温度升高,汽液共存线趋短,结束于C点,此点称为临界点。在此点,汽相与液相的差别消失。温度高于C点之值时,不可能再出现象LCV面上所代表的那种汽液两相共存的状态。 C点所在位置的压力、体积和温度,分别称为临界压力pC、临界体积VC和临界温度TC。在临界点上,p对V的一阶偏导数和二阶偏导数均为零,即
。当温度低于临界温度时,流体(如V″点)被等温加压后,便经过V′L′转变为液体(如L″点);当温度高于临界温度时,流体经等温加压,就不可能出现液化现象。因此,将低于临界温度的流体称为蒸气,简称汽,将高于临界温度的流体称为气体或超临界流体(常指压力较高时的气体,它具有较大的分子扩散系数和密度,以及较小的粘度)。三个两相共存面相交于SLV线,当p、Vm、T数值恰好落在此线上时,系统中汽液固三相共存,V、L、S三点分别代表汽相、液相和固相。三个相的温度和压力虽然相等,但它们的摩尔体积各不相同。 在实际应用中,p-V-T关系常用p-Vm为坐标轴的平面图来表示,这种图称为p-V图(图2)。图中的虚线是等温线,图上的临界点C,各共存区和各单相区均可与p-V-T图对照。
p-V-T关系的数学描述
p-V-T关系的基础数据须由实验测得。为了便于应用,常将实验数据关联成某种形式的数学方程,即状态方程。为满足工程计算的需要,还利用对应态原理建立了各种普遍化的p-V-T关系,如普遍化压缩因子图和普遍化状态方程,它们可近似应用于缺乏实验数据的物质。
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)