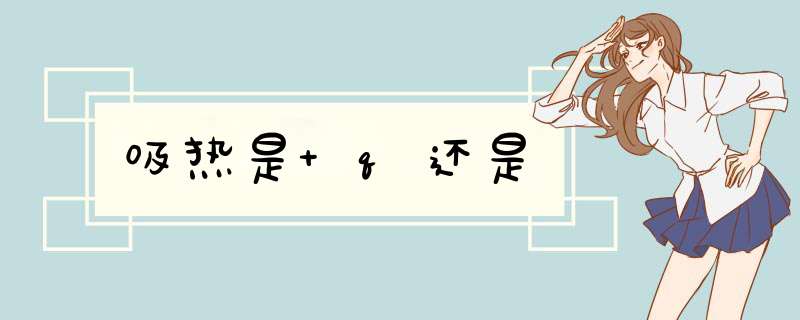
吸热是+q。但是在热化学反映方程式里的+q,-q的意思是不一样,1、在=的左边,+q表示吸热,-q表示放热;2、在=的右边,+q 表示放热,-q表示吸热。
吸热,是指物体本身的温度升高,吸收外界的热量,外界温度降低。
化学中的吸热反应大致包括两类:
(1)大多数反应条件为“高温”的反应,例:CO2+C==高温==2CO;
(2)大多数分解反应,例:2H2O2==MnO2==2H2O+O2↑。
但这也不是绝对的,比如说,制取氧气的一个反应:2KClO3==MnO2、△==2KCl+3O2↑,它虽然是分解反应,但却是一个典型的。
吸热反应是在反应过程中吸收热量的化学反应。在吸热反应中,破坏化学键吸收的热量大于形成化学键羧释放的能量。例如赤热的炭和水蒸气作用生成水煤气(等体积的氢和一氧化碳的混合物)的反应。
注意:不是需要加热的化学反应都是吸热反应。
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)