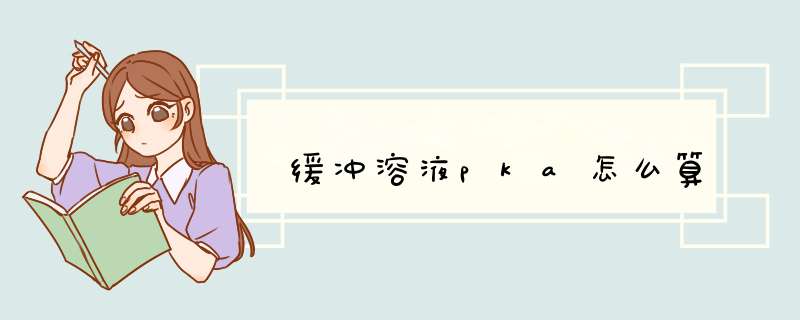
PH=PKa+lg[CH3COONa]/[CH3COOH],代入数值得 5=475+lg[CH3COONa]/[CH3COOH],
所以[CH3COONa]/[CH3COOH]=178
设加入xmL盐酸,则n(HCl)=05x/1000=00005x(mol)
初始时醋酸钠的量为004200/1000=00008(mol),根据反应式,与盐酸反应的醋酸钠为00005x,生成的醋酸为00005x,剩余的醋酸钠为00008-00005x
[CH3COONa]/[CH3COOH]=(00008-00005x)/00005x=178,解得x=058mL
平衡常数的方程式为:
-lgKa,就是电离常数的负对数。
浓度大,电离能力强,可以忽略水的电离。
那么根据电离平衡,有[H+][Ac-]/[HAc]=Ka([]代表平衡浓度)
设[H+]=x,那么[Ac-]也是x,[HAc]=01-x,带入上面的方程,解方程就行。
需知:
pka值影响物质的活性、水溶性和光谱性质。在生物化学中,蛋白质和氨基酸侧链的PKA值对酶的活性和蛋白质的稳定性非常重要。以代表一种酸离解氢离子的能力。该平衡状况是指由一种酸(HA)中,将氢离子(即一粒质子)转移至水(H2O)。水的浓度([H2O])是不会在系数中显示的。
共轭酸碱对组成的缓冲溶液,由弱酸及弱酸盐组成的缓冲溶液pH = pKa-logC酸 / C盐,由弱碱及弱碱盐组成的缓冲溶液,pOH = pKb-logC碱/ C盐。PH=-lgcH+,PKa=-lgKa 由于在不同的酸这个常数会有所不同,所以酸度系数会以常用对数的加法逆元,以符号pKa,来表示:较大的Ka值(或较小的pKa值)代表较强的酸,这是由于在同一的浓度下,离解的能力较强。
利用酸度系数,可以容易的计算酸的浓度、共轭碱、质子及氢氧离子。如一种酸是部份中和,Ka值是可以用来计算出缓冲溶液的pH值。
求解过程如下:
对弱碱性药有pKa-pH=lg(C解离型/C未解离型);
因为,pKa=84,pH=74;
所以,84-74=1=lg(C解离型/C未解离型);
推出:C解离型/C未解离型=10;
我们可以将解离型假设为100x,未解离型假设为10x;
则,解离度=解离型/(解离型+未解离型)
=100x/(100x+10x)
=09090
所以此弱碱性药物药物的解离度为91%(09090)。
扩展资料:
药物解离度的计算方法:
1、判断药物的酸碱性,若药物是弱酸性的,则有公式pH-pKa=lg(C解离型/C未解离型);若药物是弱碱性的,则有公式pKa-pH=lg(C解离型/C未解离型);
2、计算或根据条件得到pKa、pH的数值,将pKa、pH的数值代入公式中;
3、计算公式,得到C解离型/C未解离型的值,由于C解离型/C未解离型是一个比值,因此可以随意赋值,保持其比不变即可;
4、赋值后,根据公式解离度=解离型/(解离型+未解离型),即可求出解离度。
参考资料来源:百度百科—解离度
Kb=logPKa
Ka酸度系数:
酸度系数,又名酸离解常数,代号Ka值,在化学及生物化学中,是指一个特定的平衡常数,以代表一种酸离解氢离子的能力,该平衡状况是指由一种酸HA中,将氢离子,即一粒质子,转移至水,水的浓度是不会在系数中显示的,平衡状况亦会以氢离子来表达,反映出酸质子理论。
平衡常数的方程式为,由于在不同的酸这个常数会有所不同,所以酸度系数会以常用对数的加法逆元,以符号pKa来表示,一般来说,较大的Ka值,或较小的pKa值代表较强的酸,这是由于在同一的浓度下,离解的能力较强。
利用酸度系数,可以容易的计算酸的浓度,共轭碱,质子及氢氧离子,如一种酸是部分中和,Ka值是可以用来计算出缓冲溶液的pH值,在亨德森-哈塞尔巴尔赫方程亦可得出以上结论。
浓度大,电离能力强,可以忽略水的电离。那么根据电离平衡,有[H+][Ac-]/[HAc]=Ka([]代表平衡浓度)
设[H+]=x,那么[Ac-]也是x,[HAc]=01-x,带入上面的方程,解方程就行了。
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)