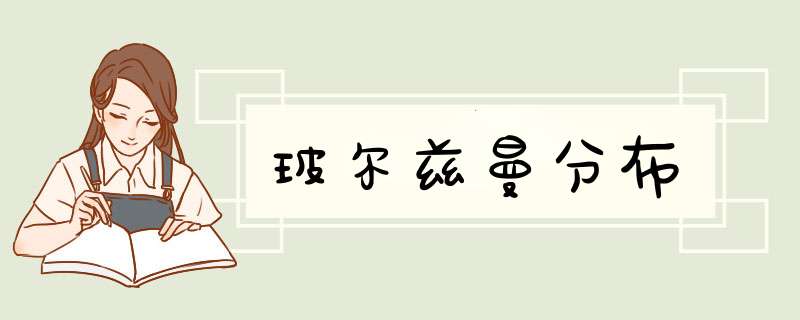
玻尔兹曼分布是系统中的粒子在各种可能的能量态下的数量分布:n∝e^(-E/kT)E表示某个能量态的能量,n为处于能量态E的粒子数。
当看到上述公式时,大部分人会被它吸引,但往往没有注意到,其最大的魅力在于自然常数e,又被称为欧拉数,是自然界普遍存在,与π同样令人神往的常数。
若是换成n∝5^(-E/kT),那重视程度可以说大打折扣。
因此理解玻尔兹曼分布的关键在于该公式的指数形式e^(-E/kT)必然不是特殊的,而是普遍适用的。
以下引用费曼的观点,摘自《费曼物理学讲义》(注:译文语句并不通俗易懂,讲究下吧)。
该定律可以表述为:系统中任何一点的密度正比于e^(- 粒子的势能/kT)。
无论作用在分子上的力是哪种力,比方说,重力、电场力或者存在某种随位置而变化的吸引力等等。
为了简单起见,现在我们假定分子全都相同,在每一单个分子上都有力的作用,因而作用在一小部分气体上的总的力就是分子数乘以作用在每个分子上的力。
同时为了避兔不必要的麻烦,假设我们所选择的坐标系的x轴沿力F的方向。
如果我们在气体中取两个相隔为dx的平行平面,那么,作用在每个分子上的力乘以每立方厘米的粒子数n,再乘以dx,必须与压强P的改变量相平衡:nFdx=dP=kTdn或者,也可以将这个规律写成这样的形式:Fdx=kTd(ln n)现在,可以看出-Fdx是使分子从x跑到x+dx我们所要做的功,如果F由势而来,也就是说,如果所做的功完全可以用势能来表示的话,那么这也就等于势能E之差。
势能微分的负值就是所做的功Fdx,因而得出:d(ln n)=-dE/kT两边积分后得:n=Ce^(-E/kT)C表示常数。
总而言之,自然常数e揭示了玻尔兹曼分布定律的普遍性,蕴含了某种深刻的含义。
玻尔兹曼(L.E.Boltzmann,1844-1906)是十九世纪后半期奥地利的杰出物理学家,他在之前英国物理学家麦克斯韦的一个关于气体分子运动统计理论的基础上进行了拓展,得到了具有更加广泛适用性的微观粒子运动系统的统计分布规律,这就是物理学界所称的玻尔兹曼分布律。
从物理学的角度看,所谓玻尔兹曼分布律是这样一个规律:对于一个具有大量粒子并且数量不变、粒子之间相互独立(即没有相互作用)、总能量确定(或者温度确定)的平衡态系统,其中存在着一系列按照能量级别不同可以加以区别的微小子系统(或状态),每个子系统中的粒子数与该子系统的能级大小成指数反比。
换言之,子系统的能量越高则含有的粒子数就越少。
最简单的公式和图示如下:上图的玻尔兹曼分布公式中,n是能级Ep的粒子数,n。
是系统粒子总数,T是系统温度,k是玻尔兹曼常数。
将公式绘成曲线图可以看出,曲线有一个顶点,意味着整个系统存在着一个粒子数最多的能量子系统,亦即最可几状态。
并且整个系统的宏观能量(或温度)越高,则曲线越扁平,高能量粒子也就相对可能更多,但最可几能态的粒子数却可能更少。
实际上,玻尔兹曼分布律目前已经超出了物理学范围,可以应用到更广泛的领域中。
比如经济领域社会人群的收入分布分析、地球大气质量分布和总质量估计、人工智能的深度学习神经网络分析等。
一家之言,欢迎拍砖!
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)