
一、电动车辆
电动车辆则是另一个节能、减排的发展方向。此处所指的“电动车辆”,是一个广义概念,大体上包含下列分支:纯电动汽车、燃料电池汽车和混合动力汽车。
一、纯电动汽车 顾名思义,也就是完全由电力驱动、而没有其他动力设备和能源装置的车辆。其动力系统很简单:电池组—电动机—车辆传动系…
电动机的效率远高于内燃机,而且在工作时没有任何化学污染物的排放,对节能和环保都有很大的意义。而且其机械传动和控制系统也不是非常复杂。
但纯电动车辆也存在一些问题:
(1)最主要的,纯电动车辆电池组的能量密度偏低。无论采取何种先进电池技术,就目前技术水平而言,单位重量的电池所能储存的电能,远低于同样重量燃油所能释放出来的机械功。这就意味着,要么牺牲动力性和续驶历程、要么极大的增加车载电池的重量。而对于很多运输任务而言,这两个选择都是难以接受的。
(2)另外,纯电动车辆的充电场所和充电时间都存在问题。
(3)如果我们深入研究其能量转换链,会发现,纯电动车辆最终很可能还是依赖化石燃料(或者水电、核能;单纯的太阳能或者风能等完全清洁能源基本上不现实)。
石油或者煤炭经过发电设备转化成电能、经过输变电、给电动车的电池充电、再由电池放电给电机做功。能量转换次数较多,最终对化石燃料的利用率并不很高;而且所谓“零排放”只是对于车辆行驶环境而言,发电的过程及其设备维护很可能还是存在污染。(对于发电行业来说,虽然采用的技术在不断地升级,如开发出了超高压、超临界、超超临界机组,开发出了流化床燃烧和整体气化联合循环发电技术,但这种努力的结果是:机组规模巨大、超高压远距离输电、投资上升,到用户的综合能源效率仍然只有35%左右,大规模的污染仍然没有得到根本解决。)
(4)大容量电池组的成本较高,维护较复杂,其制造和维护过程中很可能会产生大量污染物。
二、燃料电池车辆
目前车辆行业界的一个共识:电动车辆、乃至所有“清洁能源汽车”的终极技术目标,就是燃料电池。
1.基本定义 燃料电池是将所供燃料的化学能直接变换为电能的一种能量转换装置,是通过连续供给燃料从而能连续获得电力的发电装置。由于其具有发电效率高,适应多种燃料和环境特性好等优点,近年来已在积极地进行开发。
依据电解质的不同,燃料电池分为碱性燃料电池(AFC)、磷酸型燃料电池(PAFC)、熔融碳酸盐燃料电池(MCFC)、固体氧化物燃料电池(SOFC)及质子交换膜燃料电池(PEMFC)等。
燃料电池不受卡诺循环限制,能量转换效率高,洁净、无污染、噪声低,模块结构、积木性强、比功率高,既可以集中供电,也适合分散供电。
2.基本结构与工作原理
(1)燃料电池
燃料电池从本质上说是一种电化学装置,其基本组成与一般电池相同。
为实现较大功率的输出,燃料电池通常由若干“单体电池”组成。与普通电池类似,单体燃料电池是由正负两个电极(负极即燃料电极,正极即氧化剂电极)以及电解质组成。
不同的是一般电池的活性物质贮存在电池内部,因此,限制了电池容量。而燃料电池的正、负极本身不包含活性物质,只是个催化转换元件。因此燃料电池是名符其实的把化学能转化为电能的能量转换机器。电池工作时,燃料和氧化剂由外部供给,进行反应。原则上只要反应物不断输入,反应产物不断排出,燃料电池就能连续地发电。
这里以氢-氧燃料电池为例来说明燃料电池的基本工作原理。
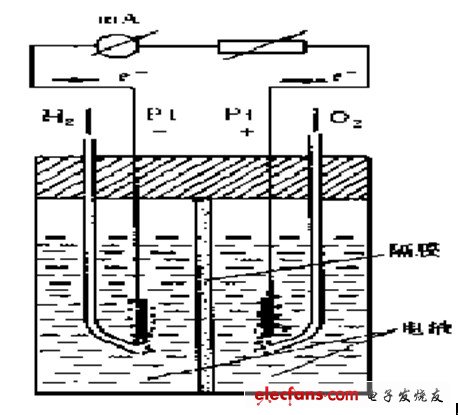
氢-氧燃料电池反应原理
这个反映是电觧水的逆过程。电极应为:
负极: H2 + 2OH- →2H2O + 2e-
正极: 1/2O2 + H2O + 2e- →2OH-
电池反应:H2 + 1/2O2==H2O
另外,只有燃料电池本体还不能工作,必须有一套相应的辅助系统,包括反应剂供给系统、排热系统、排水系统、电性能控制系统及安全装置等。
燃料电池通常由形成离子导电体的电解质板和其两侧配置的燃料极(阳极)和空气极(阴极)、及两侧气体流路构成,气体流路的作用是使燃料气体和空气(氧化剂气体)能在流路中通过。
在实用的燃料电池中因工作的电解质不同,经过电解质与反应相关的离子种类也不同。PAFC和PEMFC反应中与氢离子(H+)相关,发生的反应为:
燃料极:H2 =2H+ + 2e- (1)
空气极:2H+ + 1/2O2 +2e-= H2O (2)
全体:H2+1/2O2 = H2O (3)
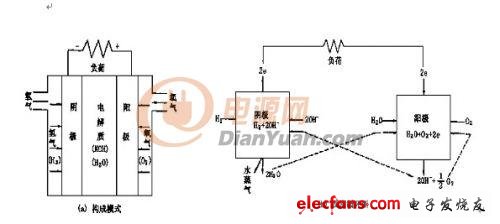
氢氧燃料电池组成和反应循环图
在燃料极中,供给的燃料气体中的H2 分解成H+ 和e- ,H+ 移动到电解质中与空气极侧供给的O2发生反应。e- 经由外部的负荷回路,再反回到空气极侧,参与空气极侧的反应。一系例的反应促成了e- 不间断地经由外部回路,因而就构成了发电。并且从上式中的反应式(3)可以看出,由H2 和O2 生成的H2O ,除此以外没有其他的反应,H2 所具有的化学能转变成了电能。但实际上,参与电化学反应的电极存在一定的电阻,电流通过时会引起了部分热能产生,由此减少了转换成电能的比例。
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)