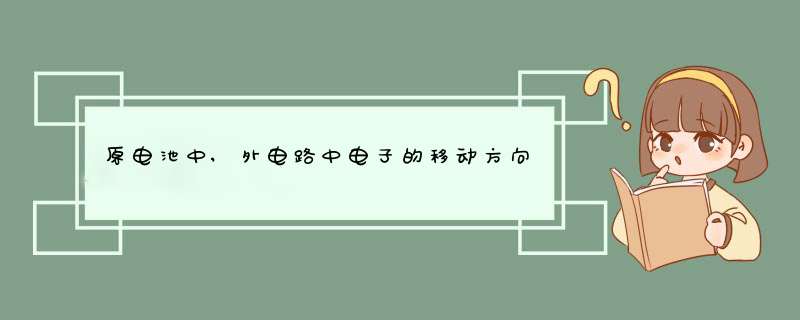
原电池放电时,负极发生氧化反应,正极发生还原反应。例如铜锌原电池又称丹聂尔电池,其正极是铜极,浸中硫酸铜溶液中;负极是锌板,浸在硫酸锌溶液中。
两种电解质溶液用盐桥勾通,两极用导线相连就组成原电池。平时使用的干电池,是根据原电池原理制成的。
扩展资料:
原电池反应属于放热的反应,一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。
两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的化学反应。也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池。
参考资料来源:百度百科--原电池原电池内电路的阴阳极是根据溶液中离子的迁移方向确定的,即阳离子移向的极是阴极,阴离子移向的极是阳极。电子只在外电路中(金属导线)中移动,不能在溶液中移动,根据电子的流动方向确定原电池的正负极,即电子流出的一极为负极,电子流入的一极为正极。这里有个技巧,即原电池的负极就是内电路的阳极,正极就是内电路的阴极。
在原电池中,外电路靠电子的流动形成电流,内电路靠阴阳离子的定向移动形成电流,从而行成一个闭合回路。先说概念:电子跟电流是两个概念!电子在导体中的定向流动,我们称之为电流,电子是实质存在的,也是会运动的,电流只是一个名字而已,是虚无的,电流=电子在移动,是为了方便而整出来的一个词。导体中有电子在移动,我们就说 有电流。
接着我们说运动方式:电子在导线里面是从电池的负极出发经过导线走到正极上面,再回到电池里面,这就是电子运动的全过程。但是科学家们规定(看好,这是人规定的,拿来说事的而已)导体中的电流是从正极流向负极,这只是方便我们判断电流的方向,而不去在意电子是怎么走的(毕竟你能把这个理解就已经很头大了 这里只讨论导体中的运动方向 先不讨论电池内部的运动方向)
然后说运动原因:如果一个电池接上了负载(设备 用电器) 那么这个电池正负极之间(电池内部)就存在电场,电场存在电场力,这个力的大小我们用场强来表示。因为有电场力的作用,所以电子就会被推着走(电场力是从正极到负极的一个作用力,在电池内部电子是被电场力从正极推到负极的 但是导体是等电位的,也就是说导体吧正极跟负极接到了一起,为了达到平衡,在内部被推倒负极的电子会从外部也就是导线回到正极)表现在外部就是从负极走到正极。也许我说的太难懂了!
最后的结论:电子A从负极出发,有负载(有接导体)的话电子A一定就会从负极出发经过导体回到正极,这是一定的,如果没有接导体的话那就是无规则运动了,他有可能去到哪里谁也说不准。自然界中只有两种电荷,正电荷和负电荷,电子属于一种负电荷
正电荷从电势高的地方移动到电势低的地方
负电荷从电势低的地方移动到电势高的地方
从外部电路中来看,正电荷从正极移动到负极,负电荷(比如电子)从负极移动到正极
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)