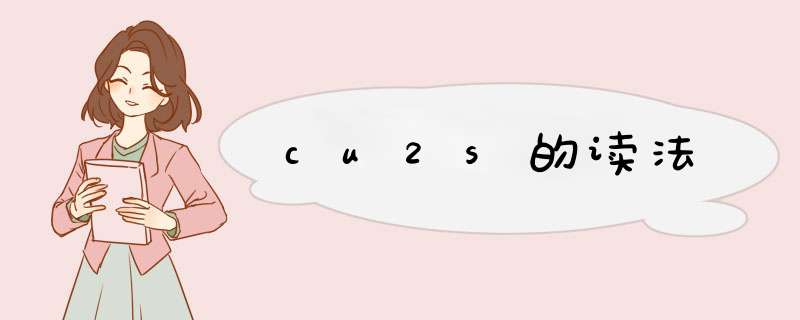
cu2s的读法:硫化亚铜。
Cu2S有两种形式,其中一种低温单斜形的结构复杂,称为低辉铜矿,在一个晶格中有96个铜原子,有着六边形结构,超过140°C也稳定。
在这种结构中,有24个晶体学上单独的铜原子,而且这种结构近似一个被铜原子和硫原子紧紧挤满的六边形结构。这种结构起初被指定为斜方晶系,因为其有成对的晶体。
制取方法:
由化学计量的铜和硫混合物在高真空封管内加热至400℃或由硫化铜在氢和硫化氢混合气流中加热至700℃而得,或者在硫酸铜溶液中加入硫代硫酸钠溶液共热也可制得。Cu2S可由热的铜在硫蒸气或H2S反应制得。
铜粉在熔融的硫中快速反应生成Cu2S,但颗粒较粗的铜参加该反应则要求更高的温度,Cu2S与氧气反应生成Cu2O和SO2:2Cu2S + 3O2 → 2Cu2O + 2SO2在生产过程中,三分之二的熔融硫化亚铜会发生上述的氧化。
将H₂S气体通入含有大量Cu²⁺的溶液中生成硫化铜沉淀:
CuSO₄+ H₂S=CuS↓ + H₂SO₄
对热不稳定,加热至220℃时分解为硫化亚铜和硫单质:
2CuS=Cu₂S+S(条件220℃)
扩展资料:
一、化学性质
有还原性,易被浓,稀硝酸,浓硫酸所氧化而溶解:
CuS+8HNO₃(浓)=CuSO₄+8NO₂↑+4H₂O
3CuS+8HNO₃(稀)=3CuSO₄+8NO↑+4H₂O
CuS+4H₂SO₄(浓=CuSO₄+4SO₂↑+4H₂O
在空气中也可以被氧气缓慢氧化:2CuS+O₂=2CuO+2S
而在加热时可迅速被氧气氧化:2CuS+3O₂=2CuO+2SO₂
二、铜化合物
铜常见的价态是+1和+2。
1、铜(I)
铜(I)通常称为亚铜,氯化亚铜(CuCl)、氧化亚铜(Cu₂O)、硫化亚铜(Cu₂S)都是常见的一价铜化合物。[Cu(NH₃)₂]²⁻是亚铜和氨的配离子,无色,易被氧化,在酸性溶液中自行歧化,生成Cu(II)和Cu。
2、铜(II)
铜(II)是铜最常见的价态,它可以和绝大部分常见的阴离子形成盐,如众所周知的硫酸铜,存在白色的无水物和蓝色的五水合物。碱式碳酸铜,又称铜绿,有好几种组成形式。氯化铜和硝酸铜也是重要的铜盐。
铜(II)可以形成一系列的配离子,如Cu(H₂O)₄(蓝色)、CuCl₄(黄绿)、Cu(NH₃)₄(深蓝)等,它们的颜色也不尽相同。
三、常见铜化合物
硫酸铜、醋酸铜、氧化铜和氧化亚铜、氯化铜 和氯化亚铜 、硝酸铜、氰化铜、脂肪酸铜、环烷酸铜等 。
参考资料来源:百度百科-铜
参考资料来源:百度百科-硫化铜
硫化亚铜的化学式为:Cu2S铜:+1价,硫:-2价.
亚铜指的是+1价的铜,所以在该化合物中,硫只能显负价,因此它的化合价为-2价
如果不懂请追问,在线为你解答
【如果帮到了你,请及时采纳,你的满意采纳,我的无限动力,谢谢配合 (*^_^*) 】
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)