
肿瘤,是危害我们身体最可怕的恶魔之一。要想制服它,首先就是要准确地找到它,看它是怎么活动的,然后才能开展有针对性的治疗。
自德国科学家伦琴发现X射线以来,人们发现可以通过很多的物理媒介来看到人体的各种器官和组织。于是百年来,X射线(X光CT)、伽马射线(正电子发射断层成像)、射频波(磁共振成像)、超声波(超声成像)等各种技术快速发展并应用于医学诊断,极大地促进了人类对于多种疾病的生物医学认知和临床诊疗能力。
肿瘤组织也是能通过上述这些技术看到的。但是,面对恶性肿瘤之所以称之为“恶魔”,自然有它更令人生畏的本领。
首先,非特异性的影像技术并不能很好地观测到所有的肿瘤,因此恶性肿瘤往往能在患者体内发展到中晚期。此时,肿瘤细胞已转移扩散,很难界定其分布范围;而具有强特异性的影像方法,却又由于对人体有损害、花费贵等原因,较难用于日常身体检查。
此外,即使恶性肿瘤被观测到,受限于成像技术,肿瘤细胞术在体内的转移范围和术后的残留量也很难确定。肿瘤细胞往往会残留在体内,随后东山再起。
所以,要想用影像技术准确地找到肿瘤“恶魔”,可能还需要花费更多的功夫。
光学分子影像:用光学信息捕捉到肿瘤“恶魔”
光学分子影像出现,为人们提供了新的影像技术手段。光学分子影像技术,是指成像目标(例如肿瘤)由于药物介入等原因会产生特定波长的光学信息。通过对这些光学信息进行采集并推导其光源分布,进而在分子层面上寻找和跟踪成像目标的运动轨迹。
光学分子影像断层可视化小鼠颅内脑胶质瘤区域(蓝色区域) 举个例子,在进行光学分子标记后,生物体的身体里如果出现了肿瘤细胞,由于荧光效应,肿瘤细胞会发出一种特定谱段的光子。这些光子通过与生物组织的相互作用,会有一部分到达生物体的皮肤,从而被光学探测器捕捉,形成像摄影照片一样的图像。这时候,医生就可以看到肿瘤的产生并捕捉到它的踪迹。
光学分子影像可以提供极高的肿瘤成像灵敏度和特异性,又安全无辐射,目前已经被广泛应用于肿瘤的预临床动物模型研究中,并逐步开展了肿瘤临床诊疗的转化应用。
从二维到三维,科学家一直在尝试
然而,光学分子影像却不得不面对一个明显的瓶颈:所有的光学图像只能定性地反映动物体表是否有光透出,这是一种二维成像,无法反映出光源在生物体内的三维空间位置,难以确定肿瘤具体发生在动物体内的哪个器官、哪片组织。
所以,科学家们开展琢磨,如何才能把光学分子影像技术从二维发展到三维?于是,光学散射断层成像方法被逐步提出,试图通过动物体表的二维光斑图像,三维重建出动物体内的光源位置。
这种重建策略在2000年左右就被提出,经过近20年的发展,科学家们在模型精度和算法速度方面已经做了很多的工作。但是,由于光子在生物体内不走直线,而是高散射传播,生物体内不同器官和组织对于光子的散射能力又千差万别。因此,这种方法一直受困于成像精度不够、实用性不足。
利用AI,画出“不走寻常路”肿瘤细胞的三维影像图
日前,中国科学院自动化研究所分子影像院重点实验室,摒弃了传统成像方法的思路,提出一种基于人工智能策略的新型重建方法。
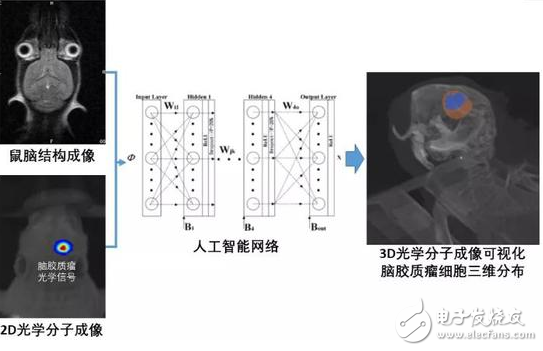
该网络以鼠脑结构为依托训练重建模型,并以2D光学分子成像结果作为网络输入,重建得到三维光学光源(脑胶质瘤)分布结果。
这种方法充分利用了人工智能网络的优势,完全舍弃构建模型去描述光子在生物体内的传播,而是构建了大量的仿真数据集训练人工智能网络,让计算机自己去“学习”和“理解”体表光斑和体内光源的关系,然后构建出一个新的模型,最终准确定位肿瘤细胞的三维位置,绘制出它活动路径的三维分布图。
该方法显著提高了成像精度。一系列实验结果表明,这种新型人工智能方法对于肿瘤的三维定位误差均小于80微米,而传统方法的定位误差为350微米以上。
这项研究表明,人工智能在提高生物医学成像的成像精度上,有着显著的优越性和应用潜力,为疾病动物模型乃至临床患者的影像学研究提供了全新的思路。
也就是说,借助人工智能的力量,人们在定位和跟踪肿瘤“恶魔”的进程中,又往前迈进了一步。而如何更快、更准确地找到肿瘤“恶魔”,依然是科学家们所努力的方向。
欢迎分享,转载请注明来源:内存溢出

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)